Ureia
A Wikipédia tem o portal:
|
| Ureia Alerta sobre risco à saúde | |
|---|---|
 |  |
Nome IUPAC | diaminometanal |
| Outros nomes | Carbamida |
| Identificadores | |
Número CAS | |
SMILES |
|
| Propriedades | |
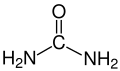
Fórmula molecular | (NH2)2CO |
Massa molar | 60.07 g/mol |
| Aparência | sólido branco inodoro |
Densidade | 1.33·10³ kg/m³,[1] sólido |
Ponto de fusão | 132.7 °C (406 K) |
Ponto de ebulição | n.a. |
Solubilidade em água | 108 g/100 ml (20 °C) 167 g/100 ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) 733 g/100 ml (100 °C) |
Acidez (pKa) | 26.9 |
Basicidade (pKb) | 13.82 |
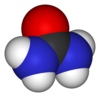
| Estrutura | |
Momento dipolar | 4.56 p/D |
| Riscos associados | |
MSDS | ScienceLab.com |
| Principais riscos associados | Tóxica |
NFPA 704 |  1 2 0 |
| Compostos relacionados | |
| Outros aniões/ânions | Ácido carbâmico (um -NH2 substituído por -OH; instável) Guanidina (C=O trocado por C=NH) |
Amidas relacionados | Formamida Acetamida Oxalamida Biureto N-metilureia |
| Compostos relacionados | Tioureia Cianato de amônio (isômero) |
Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ureia é um composto orgânico cristalino, incolor, de fórmula (NH2)2CO, com um ponto de fusão de 132,7 °C.
Tóxica, a ureia forma-se principalmente no fígado, sendo filtrada pelos rins e eliminada na urina ou pelo suor, onde é encontrada abundantemente; constitui o principal produto terminal do metabolismo proteico no ser humano e nos demais mamíferos. Em quantidades menores, está presente no sangue, na linfa, nos fluidos serosos proveniente da decomposição das células do corpo e também das proteínas dos alimentos. A ureia também está presente no mofo dos fungos, assim como nas folhas e sementes de numerosos legumes e cereais. É solúvel em água e em álcool, e ligeiramente solúvel em éter.
A ureia foi descoberta por Hilaire Rouelle em 1773. Foi o primeiro composto orgânico sintetizado artificialmente em 1828 por Friedrich Woehler, obtido a partir do aquecimento do cianato de amônio (sal inorgânico). Esta síntese derrubou a teoria de que os compostos orgânicos só poderiam ser sintetizados pelos organismos vivos (teoria da força vital).
As principais aplicações da ureia são:
- Na manufatura de plásticos, especificamente da resina ureia-formaldeído.
- Devido ao seu alto teor de nitrogênio, a ureia preparada comercialmente é utilizada na fabricação de fertilizantes agrícolas.
- Como estabilizador em explosivos de nitrocelulose.
- Na alimentação de ruminantes.
- Pode ser encontrada em alguns condicionadores de cabelo e loções.
- Utilizado para aumentar a solubilidade de corantes na indústria têxtil.
- Na produção de ARLA32 (AdBlue), reagente utilizado no SCR para reduzir NOx em veículos Diesel - SCR (Catalisador de Redução Seletiva).

A citrulina, junto com a arginina, participam do ciclo da ureia.
Ureia em uma cela eletrolítica na decomposição de cobre |
A adição da ureia se faz necessária para a solução ficar isenta de íon nitrito que impedem a deposição completa do cobre; logo, em uma solução eletrolítica a finalidade da ureia é remover vestígios dos íons nitrito.
Reação:
- 2H+ + 2NO2- + CO(NH2)2 → 2N2 + CO2 + 3H2O
Referências
↑ http://webmineral.com/data/Urea.shtml
Ligações externas |
- O ciclo da ureia e sua importância no metabolismo
